
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Viimeksi muokattu 2025-01-22 16:58.
The standardientalpia reaktion (ΔHorxn) voi olla laskettu summasta muodostumisen standardientalpiat tuloista (jokainen kerrottuna sen stoikiometrisellä kertoimella) vähennettynä muodostumisen standardientalpiat reagensseista (jokainen kerrottuna stoikiometrisellä kertoimellaan) - tuotteet
Samoin mikä on normaali palamisenalpia?
Normaali palamisentalpia määritellään nimellä entalpia muuttuu, kun yksi mooli yhdistettä palaa kokonaan hapessa kaikkien niiden sisältämien reagenssien ja tuotteiden kanssa standardi valtion alla standardi olosuhteissa (298K ja 1 bar paine).
Tiedä myös, mitkä ovat entalpian yksiköt? The SI-yksikkö ominaisentalpia on joule kilogrammaa kohti. Se voidaan ilmaista muina erityisinä suureina kaavalla h = u + pv, missä u on ominaissisäenergia, p on paine ja v on ominaistilavuus, joka on yhtä suuri kuin 1ρ, missä ρ on tiheys.
Voidaan myös kysyä, kuinka määrittelet entalpian?
Entalpia on järjestelmän termodynaaminen ominaisuus. Se on sisäisen energian summa, joka lisätään järjestelmän paineen ja tilavuuden tuloon. Se kuvastaa kykyä tehdä ei-mekaanista työtä ja kykyä vapauttaa lämpöä. Entalpia on merkitty H:lla; erityisiä entalpia merkitty h:lla.
Mikä on veden entalpia?
entalpia muodostumista varten H2O (l)(-285.8kJ/mol) on pienempi kuin H2O (g) (-241,82 kJ/mol).
Suositeltava:
Mitkä ovat tähtien muodostumisen vaiheet?
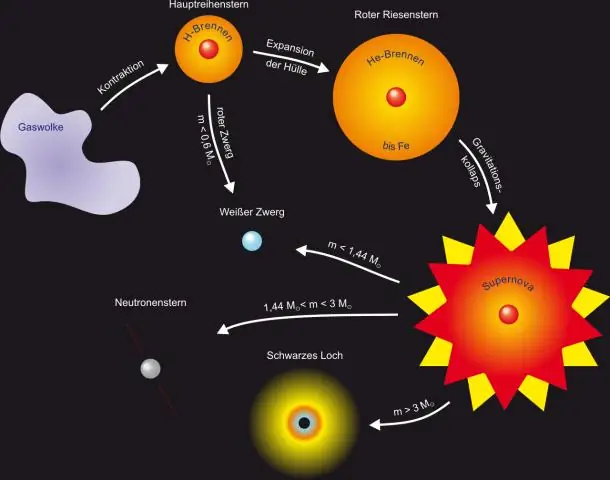
7 tähden päävaihetta Jättiläinen kaasupilvi. Tähti aloittaa elämänsä suurena kaasupilvenä. Protostari on tähtivauva. T-Tauri-vaihe. Pääsarjan tähdet. Laajentuminen Red Giantiksi. Raskaiden elementtien fuusio. Supernovat ja planeetasumut
Mikä on rikkidioksidin muodostumisen standardientalpia?

Tarkistamista varten sen pitäisi olla (&miinus;296,81±0,20) kJ/mol. Sinun tulisi käyttää NIST:iä useammin. Sain kuitenkin &miinus 310,17 kJ/mol. Sinun on ensin etsittävä ΔH∘f SO3(g):lle
Mikä on palamisen toinen nimi?

Polttaminen tulee latinan sanasta comburere, joka tarkoittaa 'polttaa.' Tulitikut, sytytys, paperi ja sytytinneste voivat olla polttovälineitä. Kemiallisesti palaminen on mikä tahansa prosessi, jossa aine yhdistyy hapen kanssa tuottaakseen lämpöä ja valoa
Mikä on Caon muodostumisen entalpia?

Taulukko yhdisteen muodostumislämpöistä δHf (kJ/mol) CaCO3 -1207,0 CaO(s) -635,5 Ca(OH)2(s) -986,6 CaSO4(s) -1432,7
Miksi alkuaineiden muodostumisen entalpia on nolla?

Alkuaineen muodostumisentalpia sen alkuainetilassa on aina 0, koska luonnollisesti esiintyvän yhdisteen muodostaminen ei vaadi energiaa. Kun aine muodostuu sen alkuaineiden vakaimmasta muodosta, tapahtuu entalpian muutos
