
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimeksi muokattu 2025-01-22 16:58.
The muodostumisen entalpia varten an elementti alkuainetilassaan tulee aina olemaan 0 koska luonnossa esiintyvän yhdisteen muodostaminen ei vaadi energiaa. Kun aine on muodostettu sen vakaimmasta muodosta elementtejä , muutos sisään entalpia tapahtuu.
Samalla tavalla voidaan kysyä, millä aineilla on nollan muodostumisentalpia?
Kaikki alkuaineet vakiotilassaan (happikaasu, kiinteä aine hiili muodossa grafiitti jne.), joiden muodostumisen vakioentalpia on nolla, koska niiden muodostumiseen ei liity muutoksia.
Tämän jälkeen kysymys kuuluu, mikä on veden muodostumisen entalpia? Valittu ATcT muodostumisen entalpia perustuu Thermochemical Networkin versioon 1.118
| Lajin nimi | Kaava | ΔfH° (298,15 K) |
|---|---|---|
| Vesi | H2O (kr, ekv.press.) | -292.740 |
Vastaavasti miksi timantin muodostumisen standardientalpia ei ole nolla, vaikka se on alkuaine?
The muodostumisen standardientalpia varten an elementti siinä standardi valtio on NOLLA !!!! Joten ΔH°f C:lle (s, grafiitti) on nolla , mutta ΔH°f C:lle (s, timantti -) on 2 kJ/mol. Tämä johtuu siitä, että grafiitti on standardi hiilen tila, ei timantti.
Mitä se tarkoittaa, kun Delta h on nolla?
Ne voivat mitata vain entalpian muutoksia. Kun entalpia on positiivinen ja delta H on suurempi kuin nolla , Tämä tarkoittaa että järjestelmä imee lämpöä. Tätä kutsutaan endotermiseksi reaktioksi. Kun entalpia on negatiivinen ja delta H on vähemmän kuin nolla , Tämä tarkoittaa että järjestelmä vapauttaa lämpöä. Tätä kutsutaan eksotermiseksi reaktioksi.
Suositeltava:
Miksi indusoitu emf on nolla, kun magneettivuo on maksimi?

Kun kela on pystyasennossa, magneettivuon (eli emf=0) muutosta ei tapahdu, koska kela ei "leikkaa" kenttälinjojen poikki. Indusoitu emf on nolla, kun kelat ovat kohtisuorassa kenttäviivoja vastaan ja maksimi, kun ne ovat yhdensuuntaisia. Muista, että indusoitu emf on magneettivuon kytkennän muutosnopeus
Miksi EMF on nolla, kun kela kulkee magneetin tarkan keskikohdan läpi?
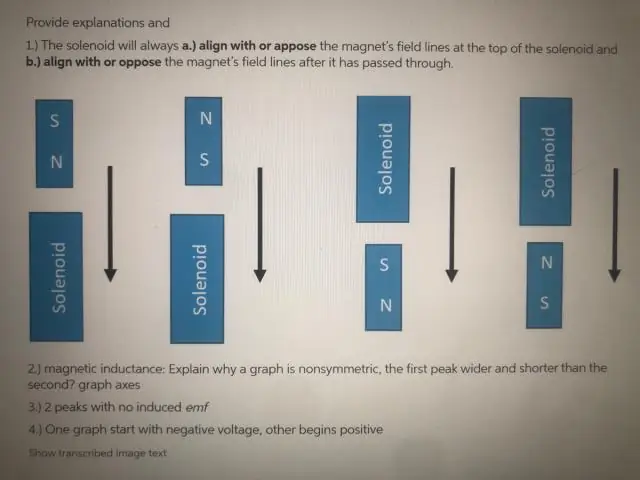
Emf on vain nolla hetken, kun magneetti kulkee kelan tarkan keskikohdan läpi. Tämä johtuu siitä, että magneetin toisessa päässä olevan N-navan vaikutus kelan kyseiseen päähän kumoutuu tarkasti magneetin S-navan vaikutuksesta kelan toiseen päähän
Mikä on Caon muodostumisen entalpia?

Taulukko yhdisteen muodostumislämpöistä δHf (kJ/mol) CaCO3 -1207,0 CaO(s) -635,5 Ca(OH)2(s) -986,6 CaSO4(s) -1432,7
Miten maapallon alkuaineiden runsaus vertaa alkuaineiden runsautta ihmisissä?

Happi on runsain alkuaine sekä maapallolla että ihmisissä. Orgaanisia yhdisteitä muodostavien alkuaineiden määrä lisääntyy ihmisillä, kun taas metalloidien määrä lisääntyy maapallolla. Maapallolla runsaasti esiintyvät alkuaineet ovat välttämättömiä elämän ylläpitämiselle
Mikä on absoluuttinen nolla ja miksi sitä kutsutaan?

Absoluuttinen nolla on -273,15 Celsius-astetta, -459,67 Fahrenheit-astetta ja 0 Kelviniä. Niin sanotaan, koska se on piste, jossa luonnon perushiukkasilla on minimaalinen värähtelyliike, ja ne säilyttävät vain kvanttimekaanisen, nollapisteen energian aiheuttaman hiukkasliikkeen
