
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimeksi muokattu 2025-01-22 16:58.
Tarkistamista varten sen pitäisi olla (−296,81±0,20) kJ/mol. Sinun tulisi käyttää NIST:ää useammin. Itse asiassa sain −310,17 kJ/mol. Sinun on ensin etsittävä ΔH∘f SO3(g):lle.
Vastaavasti voit kysyä, mikä on o2:n muodostumisen standardientalpia?
The O2:n muodostumisen standardientalpia yhtä suuri kuin 0, koska kaksiatominen happi kaasumuodossa on sen stabiilin muoto (voit vertailla sen vähemmän stabiileja muotoja nähdäksesi: yksiatominen muoto O, kolmiatominen muoto O3 jne.).
Tiedä myös, kuinka löydät muodostumisen standardintalpian? Tämä yhtälö pohjimmiltaan todetaan, että standardientalpia muutos muodostus on yhtä suuri kuin summa muodostumisen standardientalpiat tuotteista vähennettynä summalla muodostumisen standardientalpiat reagoivista aineista. ja muodostumisen standardientalpia arvot: ΔH fo[A] = 433 KJ/mol. ΔH fo[B] = -256 KJ/mol.
Lisäksi mikä on so2:n muodostumislämpö?
Kaasun muodostumisen entalpia standardiolosuhteissa (nimellisesti 298,15 K, 1 atm.)
| ΔfH°kaasua (kJ/mol) | -296.81 ± 0.20 |
| Menetelmä | Arvostelu |
| Viite | Cox, Wagman et ai., 1984 |
| Kommentti | |
|---|---|
| CODATA Tarkista arvo | |
Millä elementeillä on nollan muodostumisen standardientalpia?
Kaikki alkuaineet vakiotilassaan (happikaasu, kiinteä hiili muodossa grafiitti jne.), joiden muodostumisen vakioentalpia on nolla, koska niiden muodostumiseen ei liity muutoksia.
Suositeltava:
Mitkä ovat tähtien muodostumisen vaiheet?
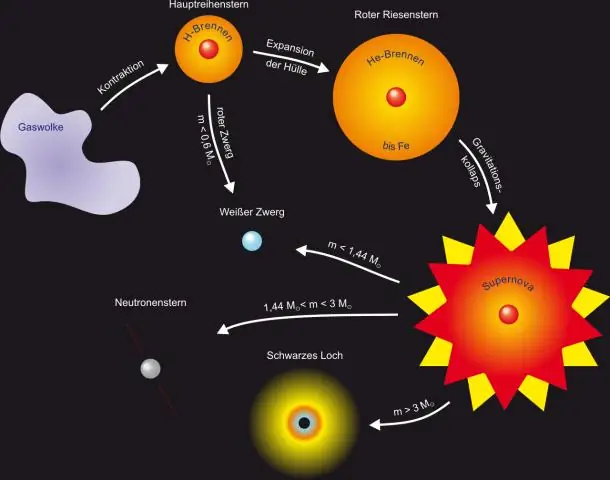
7 tähden päävaihetta Jättiläinen kaasupilvi. Tähti aloittaa elämänsä suurena kaasupilvenä. Protostari on tähtivauva. T-Tauri-vaihe. Pääsarjan tähdet. Laajentuminen Red Giantiksi. Raskaiden elementtien fuusio. Supernovat ja planeetasumut
Mikä on Caon muodostumisen entalpia?

Taulukko yhdisteen muodostumislämpöistä δHf (kJ/mol) CaCO3 -1207,0 CaO(s) -635,5 Ca(OH)2(s) -986,6 CaSO4(s) -1432,7
Mikä aiheutti kuplien muodostumisen, kun lisäsit katalaasia?

Katalaasi on maksassa oleva entsyymi, joka hajottaa haitallisen vetyperoksidin hapeksi ja vedeksi. Kun tämä reaktio tapahtuu, happikaasukuplat poistuvat ja muodostavat vaahtoa. Desinfioi täysin kaikki pinnat, joihin raakamaksa koskettaa tämän toiminnan aikana
Mikä aiheuttaa taittuneiden vuorten muodostumisen?

Poimuvuoret muodostuvat, kun kaksi tektonista laatta liikkuu toisiaan kohti lähentyvällä laatan rajalla. Kun lautaset ja niillä ratsastavat maanosat törmäävät, kertyneet kivikerrokset voivat rypistyä ja taittua kuin pöytäliina, joka työnnetään pöydän yli, varsinkin jos siinä on mekaanisesti heikko kerros, kuten suola
Mikä aiheutti kuplien muodostumisen, kun lisäsit suolahappoa sinkkimetalliin?

Elohopeaoksidi. Elohopea metalli. Kun sinkki reagoi suolahapon kanssa, reaktio kuplii voimakkaasti vetykaasun muodostuessa. Kun sinkki reagoi suolahapon kanssa, koeputki lämpenee hyvin, reaktion aikana vapautuu energiaa
