
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Viimeksi muokattu 2025-01-22 16:58.
CF4: Tetrahedraalinen, ei-polaarinen; Bond dipolit peruuttaa. SeF4 : Keinu, napa; Bond dipolit tekevät ei peruuta. KrF4, neliötasoinen, ei-napainen; Bond dipolit peruuttaa. Jälleen jokainen molekyyli on sama määrä atomeja, mutta erilainen rakenne, koska keskusatomin ympärillä on erilainen määrä yksinäisiä pareja.
Siitä, onko sf4:ssä dipolimomentti?
(c) SF4 : SiF4 on tetraedrinen ja siinä ei ole dipolimomentti . SF4 on See-Saw-molekyylimuoto. Siksi, SF4 on dipolimomentti.
Samoin, onko CCl4:llä dipolimomentti? Cl2:n tapauksessa 2 atomia ovat identtisiä, joten sidoksen polarisoituminen ei ole mahdollista, ja dipolimomentti on nolla. Samalla tavalla 4 C-Cl sitoutuu CCl4 on suunnattu osoittamaan säännöllisen tetraedrin huipuissa, ja ne kumoavat toisensa tarkasti, joten CCl4:llä on ei dipolimomentti.
Onko SiF4 tällä tavalla polaarinen vai ei-polaarinen?
SiF4 Piste Lewis -rakenne, molekyyligeometria, sidoskulma, Polaarinen tai ei-polaarinen . SiF4 ei ole napainen koska fluorien negatiiviset dipolit kumoavat toisensa, koska kaikki vetäytyvät pois keskustasta tasaisesti (keskus on pii, jolla on pienempi elektronegatiivisuus kuin fluorilla).
Onko HCL polaarinen vai ei-polaarinen?
HCL on napainen kloorilla on suurempi elektronegatiivisuus kuin vedyllä. Siten se houkuttelee elektroneja viettämään enemmän aikaa lopussa, jolloin se saa negatiivisen varauksen ja vety positiivisen varauksen. Mistä tiedät, onko Br2 polaarinen tai ei-polaarinen ?
Suositeltava:
Mitä eroa on Algebra 1:llä ja Algebra 2:lla?
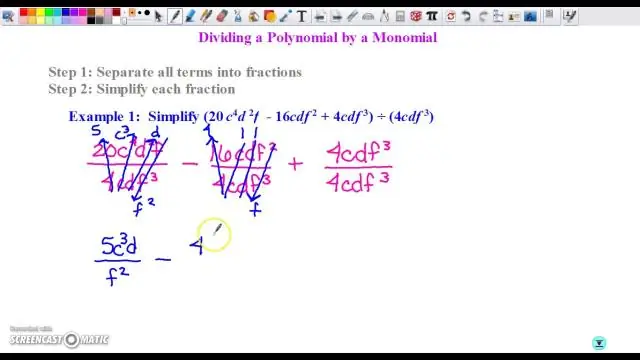
Algebran 1 pääpaino on yhtälöiden ratkaisemisessa. Ainoat funktiot, joita tarkastelet laajasti, ovat lineaariset ja neliölliset. Algebra 2 on paljon edistyneempi
Onko c2h6:lla tai c4h10:llä korkeampi kiehumispiste?

12.38 Kummalla kummallakin parilla on korkeampi höyrynpaine (a) C2H6 tai C4H10: C2H6:lla on korkeampi höyrynpaine. On olemassa vain dispersiovoimia, ja ne ovat voimakkaampia raskaammassa C4H10-molekyylissä. Tällaisissa tapauksissa raskaammilla molekyyleillä, joilla on voimakkaammat dispersiovoimat, on korkeampi kiehumispiste
Onko ch3:lla dipolimomentti?

Fluorimetaanin kaltaisella molekyylillä CH3F on pysyvä dipoli. Huomaa, että C-H-sidoksissa on myös dipoleja, mutta ne ovat niin paljon pienempiä kuin C-F-sidoksessa olevat, että niillä ei ole merkitystä. Koko dipolissa on negatiivinen varaus kertynyt fluoriin
Mitä yhteistä DNA:lla ja RNA:lla on?

Mitä yhteistä on DNA:lla ja RNA:lla? -Molemmat sisältävät deoksiriboosia. -Molemmat koostuvat nukleotideista. -Molemmat muodostavat kaksoiskierteitä
Mitä eroa on 16s rRNA:lla ja 18s RRNA:lla?

Suurin ero analyysien suorittamisen välillä 18S-rRNA-geenidatalla 16S-rRNA-geenidatan (tai ITS-datan) sijaan on OTU-poiminnassa käytetty viitetietokanta, taksonomiset tehtävät ja mallipohjainen kohdistuksen rakentaminen, koska sen täytyy sisältää eukaryoottisia sekvenssejä
