
Sisällysluettelo:
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimeksi muokattu 2025-01-22 16:58.
12.38 Kumpi kustakin parista on the korkeampi höyrynpaine (a) C2H6 tai C4H10 : C2H6:lla on the korkeampi Höyrynpaine. On vain hajontavoimia, ja ne ovat voimakkaampia raskaammissa C4H10 molekyyli. Tällaisissa tapauksissa raskaammat molekyylit, jotka on voimakkaammat hajoamisvoimat, tahto omistaa the korkeampi kiehumispiste.
Onko c3h8:lla tai c4h10:llä näin ollen korkeampi kiehumispiste?
C2H6 < C3H8 < C4H10 . Kaikki nämä yhdisteet ovat ei-polaarisia ja vain omistaa Lontoon dispersiovoimat: mitä suurempi molekyyli, sitä suuremmat dispersiovoimat ja korkeampi the kiehumispiste.
Samoin millä olisi korkeampi kiehumispiste? Neljän molekyylien välisen voiman suhteellinen vahvuus on: ioni > vetysidos > dipolidipoli > Van der Waalsin dispersiovoimat. Jokaisen näiden houkuttelevien voimien vaikutus tahtoa riippuvat läsnä olevista funktionaalisista ryhmistä. Kiehumispisteet kasvaa, kun hiilen määrä kasvaa.
Tiedä myös, millä yhdisteellä odotat olevan korkeampi kiehumispiste?
Mitä vahvempi molekyylien välinen voima, sitä korkeampi the kiehumispiste . Yleensä vetysidos on vahvempi kuin dipoli-dipoli vetovoima, joka ovat vahvempi kuin Lontoon hajoamisjoukot.
Kuinka määrität kiehumispisteen?
Esimerkki kiehumispisteen korkeudesta
- Glukoosi on liuennut aine ja vesi liuotin.
- Veden Kb on 0,51 celsiusastetta kg/mol.
- Glukoosin moolimassa on 180 g/mol.
- Veden kiehumispiste on 100 celsiusastetta.
- Kiehumispisteen nousun yhtälö on delta T = mKb.
Suositeltava:
Onko etaanilla tai eteenillä korkeampi kiehumispiste?

Etaanilla on voimakkaammat molekyylien väliset vetovoimat (van der Waalin voimat) kuin eteenillä ja niin on korkeampi kiehumispiste
Mitä eroa on Algebra 1:llä ja Algebra 2:lla?
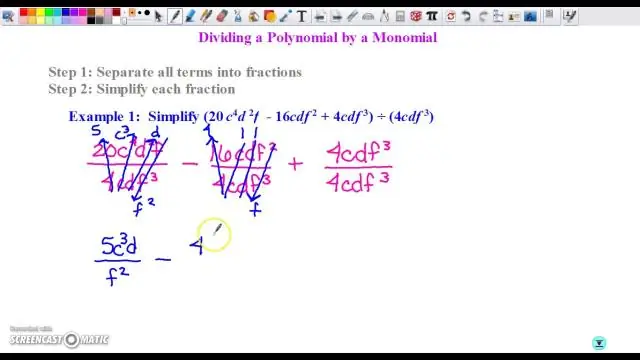
Algebran 1 pääpaino on yhtälöiden ratkaisemisessa. Ainoat funktiot, joita tarkastelet laajasti, ovat lineaariset ja neliölliset. Algebra 2 on paljon edistyneempi
Miksi etyylialkoholilla on korkeampi kiehumispiste kuin metyylialkoholilla?

Etanolilla on korkeampi kiehumispiste kuin metanolilla. Tästä syystä tarvitaan enemmän energiaa molekyylien välisten voimien voittamiseksi, mikä johtaa kiehumis-/sulamispisteiden nousuun
Mitä yhteistä DNA:lla ja RNA:lla on?

Mitä yhteistä on DNA:lla ja RNA:lla? -Molemmat sisältävät deoksiriboosia. -Molemmat koostuvat nukleotideista. -Molemmat muodostavat kaksoiskierteitä
Onko etanolilla tai asetonilla korkeampi kiehumispiste?

Siksi etanolilla (jolla on H-sidoskyky) tulee olla korkein kiehumispiste, polaarisella asetonilla on seuraavaksi korkein kiehumispiste, ja ei-polaarisella propaanilla, jolla on heikoimmat molekyylien väliset voimat, tulee olla alhaisin kiehumispiste. 41
