
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Viimeksi muokattu 2025-01-22 16:58.
Voi ei-polaarisia molekyylejä näyttely dipoli - dipolivoimat ? Dipoli - dipolivoimat tapahtuu, kun napaisen positiivinen osa molekyyli vetää puoleensa napakohdan negatiivinen osa molekyyli . Jonkin sisällä ei-polaarinen molekyyli , voi silti olla polaarisia sidoksia, se on vain, että dipolit kumoavat toisensa.
Samoin mitä molekyylien välisiä voimia ei-polaarisilla molekyyleillä on?
Jos molekyyli On ei-polaarinen , silloin ei dipoli-dipoli-vuorovaikutuksia tai vetysidoksia voi tapahtua ja ainoa mahdollinen molekyylien välinen voima on heikko van der Waals pakottaa.
Myöhemmin kysymys kuuluu, kuinka yksi ei-polaarinen molekyyli voi indusoida dipolin lähellä olevassa poolittomassa molekyylissä? A dipoli - indusoitunut dipoli vetovoima on heikko vetovoima, joka syntyy, kun napa molekyyli indusoi dipolin atomissa tai a ei-polaarinen molekyyli häiritsemällä elektronien järjestystä ei-polaarinen lajit.
Millä molekyyleillä on dipolidipolivoimat?
Polaariset kovalenttiset yhdisteet, kuten kloorivety, HCl-aloitusteksti, H, C, l, lopputeksti ja vetyjodidi, HIaloitusteksti, H, I, lopputeksti- on dipoli - dipoli osittain varautuneiden ionien ja Lontoon dispersion väliset vuorovaikutukset voimat välillä molekyylejä.
Onko vesi polaarinen vai ei-polaarinen?
Vesimolekyyli, lyhennettynä H2O , on esimerkki a napainen kovalenttisidos. Elektronit jakautuvat epätasaisesti, ja happiatomi viettää enemmän aikaa elektronien kanssa kuin vetyatomit. Koska elektronit viettävät enemmän aikaa happiatomin kanssa, sillä on osittainen negatiivinen varaus.
Suositeltava:
Voiko rikillä olla 4 sidosta?

Rikillä on tässä rakenteessa ympärillään neljä elektronia (yksi jokaisesta sen neljästä sidoksesta), joka on kaksi elektronia vähemmän kuin valenssielektronien määrä sillä normaalisti olisi, ja sellaisenaan se kantaa muodollisen +2:n varauksen
Voiko kiinteillä aineilla olla pH?
Kiinteässä faasissa ei kuitenkaan ole sellaista asiaa kuin solvataatio. Määritelmän mukaan pH liittyy liuokseen solvatoituneen vetyionin pitoisuuteen. Se voisi olla vesiliuos, jossa pH voi tyypillisesti vaihdella noin -2:sta noin 16:een
Voiko kahdella mustatukkaisella vanhemmalla olla blondi lapsi?

Kyllä, vaaleiden tai vaaleiden hiusten geenit ovat resessiivisiä tummille hiuksille, mikä tarkoittaa, että tarvitset kaksi kopiota vaaleasta geenistä (yksi äidiltä, toisen isältä) saadaksesi vaaleatukkaisen lapsen. Jos lapsi saa yhden kopion tummille hiuksille ja yhden vaaleille hiuksille, tumma on hallitseva, eli lapsella on tummat hiukset
Voiko ei-polaarisella molekyylillä olla vetysidosta?

Jos molekyyli on ei-polaarinen, dipoli-dipoli-vuorovaikutusta tai vetysidosta ei voi tapahtua ja ainoa mahdollinen molekyylien välinen voima on heikko van der Waalsin voima
Voiko chi-neliö olla negatiivinen?
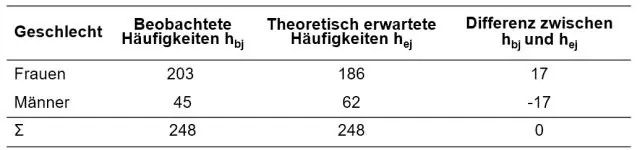
Tarkoitatko: Voivatko chi-neliön arvot koskaan olla negatiivisia? Vastaus on ei. Chi-neliön arvo ei voi olla negatiivinen, koska se perustuu neliöityjen erojen summaan (saavuttujen ja odotettujen tulosten välillä)
