
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimeksi muokattu 2025-01-22 16:58.
Jos molekyyli On ei-polaarinen , silloin ei dipoli-dipoli-vuorovaikutusta tai vetysidos voi ja ainoa mahdollinen molekyylien välinen voima on heikko van der Waalsin voima.
Yksinkertaisesti niin, voivatko ei-polaariset molekyylit muodostaa vetysidoksia?
Vesi on napaista vety ja happiatomit vedessä muodostuu molekyylejä polaarinen kovalenttinen joukkovelkakirjat . Jaetut elektronit viettävät enemmän aikaa happiatomin kanssa kuin ne tehdä kanssa vety atomeja. Vetysidokset kanssa ei helposti muodosteta ei-polaarinen öljyt ja rasvat (kuva 1).
Myöhemmin kysymys kuuluu, minkä tyyppisissä molekyyleissä on vetysidos? Vetysidos muodostuu vain kolmesta erittäin elektronegatiivisesta alkuaineesta - fluorista, hapesta ja typestä. Niin, vetysidos on mahdollista vain niissä yhdisteissä, joissa vety atomi on suoraan tullivarastossa fluorille, hapelle tai typelle.
Lisäksi esiintyykö vetysidoksia vain polaarisissa molekyyleissä?
The vetysidos sisään polaarisia molekyylejä esiintyy vain yhdisteissä, joissa on vety sitoutunut N-, O- tai F-atomiin. H-atomi vetää puoleensa N-, O- tai F-atomin osittainen negatiivinen varaus molekyyli . The vetysidos on vetovoima, mutta ei todellinen kemikaali joukkovelkakirjalaina kuten ioninen tai kovalenttinen joukkovelkakirjat.
Millainen sidos on vesi?
Vesi on polaarinen molekyyli A vettä Molekyyli muodostuu, kun kaksi vetyatomia joukkovelkakirjalaina kovalenttisesti happiatomin kanssa. Kovalentissa joukkovelkakirjalaina elektronit jaetaan atomien kesken. Sisään vettä jakaminen ei ole tasa-arvoista. Happiatomi houkuttelee elektroneja voimakkaammin kuin vety.
Suositeltava:
Voiko rikillä olla 4 sidosta?

Rikillä on tässä rakenteessa ympärillään neljä elektronia (yksi jokaisesta sen neljästä sidoksesta), joka on kaksi elektronia vähemmän kuin valenssielektronien määrä sillä normaalisti olisi, ja sellaisenaan se kantaa muodollisen +2:n varauksen
Voiko kiinteillä aineilla olla pH?
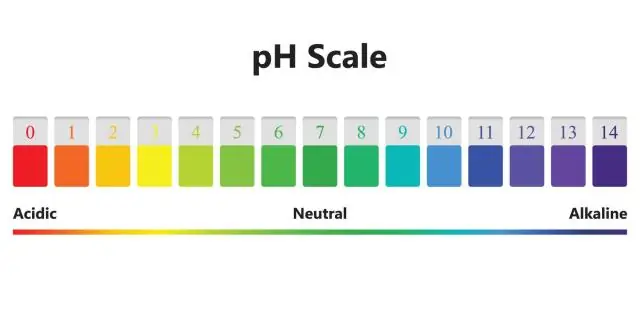
Kiinteässä faasissa ei kuitenkaan ole sellaista asiaa kuin solvataatio. Määritelmän mukaan pH liittyy liuokseen solvatoituneen vetyionin pitoisuuteen. Se voisi olla vesiliuos, jossa pH voi tyypillisesti vaihdella noin -2:sta noin 16:een
Voiko kahdella mustatukkaisella vanhemmalla olla blondi lapsi?

Kyllä, vaaleiden tai vaaleiden hiusten geenit ovat resessiivisiä tummille hiuksille, mikä tarkoittaa, että tarvitset kaksi kopiota vaaleasta geenistä (yksi äidiltä, toisen isältä) saadaksesi vaaleatukkaisen lapsen. Jos lapsi saa yhden kopion tummille hiuksille ja yhden vaaleille hiuksille, tumma on hallitseva, eli lapsella on tummat hiukset
Voiko chi-neliö olla negatiivinen?
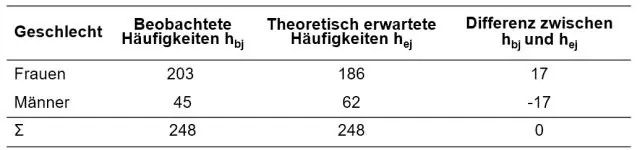
Tarkoitatko: Voivatko chi-neliön arvot koskaan olla negatiivisia? Vastaus on ei. Chi-neliön arvo ei voi olla negatiivinen, koska se perustuu neliöityjen erojen summaan (saavuttujen ja odotettujen tulosten välillä)
Onko n2:lla vetysidosta?

Typpi (N2) on ei-polaarinen molekyyli, ja se muodostaa molekyyliensä väliin vain viikoittain Lontoon dispersiovoimia. Vesi on erittäin polaarinen molekyyli, joka muodostaa vahvoja vetysidoksia molekyyliensä välille. Jos N2 voisi muodostaa vetysidoksia veden kanssa, se liukenee hyvin veteen
