
Sisällysluettelo:
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2024-01-18 08:15.
- Viimeksi muokattu 2025-01-22 16:58.
Liuoksen entalpia (liuoksen lämpö) Esimerkki
- Laskea the lämpöä vapauttanut, q, jouleina (J), jonka reaktio : q = massa(vesi) × spesifinen lämpöä kapasiteetti (vesi) × lämpötilan muutos ( ratkaisu )
- Laskea liuenneen aineen moolit (NaOH(s)): moolit = massa ÷ moolimassa.
- Laskea the entalpia muutos, ΔH, kJ mol-1 liuenneesta aineesta:
Samoin, kuinka löydät muodostumisen lämmön?
Tämä yhtälö pohjimmiltaan sanoo, että standardi entalpia muutos muodostus on yhtä suuri kuin standardientalpioiden summa muodostus tuotteista vähennettynä standardientalpioiden summalla muodostus reagoivista aineista. ja standardi muodostumisen entalpia arvot: ΔH fo[A] = 433 KJ/mol. ΔH fo[B] = -256 KJ/mol.
Tämän jälkeen kysymys kuuluu, mitä ratkaisulämpö tarkoittaa? Määritelmä / liuoksen lämpö .: lämpöä kehittyy tai imeytyy, kun aine liukenee spesifisesti: määrä, joka liittyy, kun yksi mooli tai joskus yksi gramma liukenee suureen ylimäärään liuotinta.
Tiedä myös, miten lasket lämmönmuutoksen?
Kun lämpöä siirto on mukana, käytä tätä kaavaa: muuttaa lämpötilassa = Q / cm to laskea the muuttaa lämpötilassa tietystä määrästä lämpöä lisätty. Q edustaa lämpöä lisätty, c on erityinen lämpöä lämmitettävän aineen kapasiteetti, ja m on lämmittämäsi aineen massa.
Mitä tarkoittaa palamislämpö?
Palamislämpö (ΔH°c) on muodossa vapautuneen energian mitta lämpöä (q) kun yksi mooli ainetta poltetaan ( palaminen ). Tuotanto lämpöä tarkoittaa, että reaktio on eksoterminen prosessi ja tuottaa energiaa.
Suositeltava:
Kuinka ratkaiset toisen asteen yhtälön käyttämällä nollatekijälakia?

Tästä voimme päätellä, että: Jos minkä tahansa kahden luvun tulo on nolla, niin toinen tai molemmat luvut ovat nolla. Eli jos ab = 0, niin a = 0 tai b = 0 (johon sisältyy mahdollisuus, että a = b = 0). Tätä kutsutaan nollatekijälakiksi; ja käytämme sitä usein ratkaisemaan toisen asteen yhtälöitä
Kuinka ratkaiset Hardy Weinbergin ongelmat?

VIDEO Tämän lisäksi, kuinka löydät P ja Q Hardy Weinbergistä? Siitä asti kun s = 1 - q ja q on tiedossa, se on mahdollista laske p yhtä hyvin. Tietäen p ja q , on helppo liittää nämä arvot Hardy - Weinberg yhtälö (p² + 2pq + q² = 1).
Kuinka ratkaiset ideaalikaasulain?

Ihanteellisen kaasulakikaava Ideaalikaasulakikaava Kysymyksiä: Vastaus: Tilavuus on V = 890,0 ml ja lämpötila on T = 21 °C ja paine on P = 750 mmHg. PV = nRT. Vastaus: Moolien lukumäärä on n = 3,00 moolia, lämpötila on T = 24°C ja paine on P = 762,4 mmHg. PV = nRT
Kuinka ratkaiset kaksivaiheiset yhtälöt esialgebrassa?

VIDEO Samoin mitkä ovat yhtälön ratkaisemisen 4 vaihetta? 4-vaiheinen opas yhtälöiden ratkaisemiseen (osa 2) Vaihe 1: Yksinkertaista yhtälön jokainen puoli. Kuten viime kerralla opimme, ensimmäinen askel yhtälön ratkaisemisessa on tehdä yhtälöstä mahdollisimman yksinkertainen.
Kuinka ratkaiset murtolukujen kertomisen ja jakamisen?
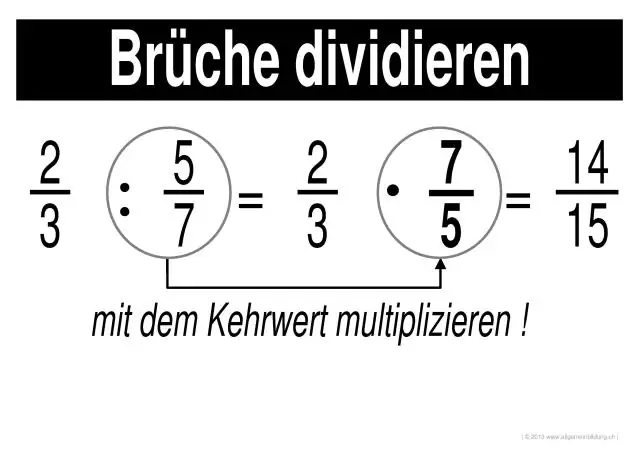
Murtolukujen kertominen ja jakaminen Vaihe 1: Kerro jokaisen murtoluvun osoittajat toisillaan (yläpuolella olevat numerot). Tulos on vastauksen osoittaja. Vaihe 2: Kerro kunkin murtoluvun nimittäjät toisilla (numerot alareunassa). Tulos on vastauksen nimittäjä. Vaihe 3: Yksinkertaista tai vähennä vastausta
