
Sisällysluettelo:
- Kirjoittaja Miles Stephen [email protected].
- Public 2024-01-18 08:15.
- Viimeksi muokattu 2025-01-22 16:58.
Ihanteellinen kaasulaki kaava
- Ihanteellinen kaasulaki Kaavakysymykset:
- Vastaus: Tilavuus on V = 890,0 ml ja lämpötila on T = 21 °C ja paine on P = 750 mmHg.
- PV = nRT.
- Vastaus: Moolien lukumäärä on n = 3,00 moolia, lämpötila on T = 24°C ja paine on P = 762,4 mmHg.
- PV = nRT.
Tämän lisäksi, kuinka lasket ihanteellisen kaasulain?
Ihanteellisen kaasun ominaisuudet on kaikki rajattu yhteen kaavaan muodossa pV = nRT, jossa:
- p on kaasun paine, mitattuna Pa,
- V on kaasun tilavuus, mitattuna m^3,
- n on aineen määrä mooliina mitattuna,
- R on ihanteellinen kaasuvakio ja.
- T on kaasun lämpötila kelvineinä mitattuna.
Samoin miksi ihannekaasulaki on tärkeä? Boylen Laki toteaa, että kun lämpötila on vakio, kiinteän näytteen paine ja tilavuus a kaasua ovat käänteisesti verrannollisia (P1 x V1 = P2 x V2). Merkitys on siis siinä, että ihanteellinen kaasulaki laskee minkä tahansa käyttäytymisen kaasua tavallisissa lämpötila- ja paineolosuhteissa.
Kysymys kuuluu myös, kuinka löydät paineen käyttämällä ihannekaasulakia?
Käydään ensin läpi ihanteellinen kaasulaki PV = nRT. Tässä yhtälössä 'P' on paine ilmakehissä "V" on tilavuus litroina, "n" on hiukkasten lukumäärä mooliina, "T" on lämpötila kelvineinä ja "R" on ihanteellinen kaasu vakio (0,0821 litraa ilmakehää kelvinmoolia kohti).
Mitkä ovat ihanteellisen kaasulain yksiköt?
SI-yksiköissä p mitataan yksiköissä pascalia , V mitataan kuutiometreinä, n mitataan mooliina ja T in kelvinit ( Kelvin mittakaava on siirtynyt Celsius asteikolla, jossa 0,00 K = -273,15 °C, alin mahdollinen lämpötila). R:n arvo on 8,314 J/(K. mol) ≈ 2 cal/(K.
Suositeltava:
Kuinka ratkaiset toisen asteen yhtälön käyttämällä nollatekijälakia?

Tästä voimme päätellä, että: Jos minkä tahansa kahden luvun tulo on nolla, niin toinen tai molemmat luvut ovat nolla. Eli jos ab = 0, niin a = 0 tai b = 0 (johon sisältyy mahdollisuus, että a = b = 0). Tätä kutsutaan nollatekijälakiksi; ja käytämme sitä usein ratkaisemaan toisen asteen yhtälöitä
Kuinka ratkaiset Hardy Weinbergin ongelmat?

VIDEO Tämän lisäksi, kuinka löydät P ja Q Hardy Weinbergistä? Siitä asti kun s = 1 - q ja q on tiedossa, se on mahdollista laske p yhtä hyvin. Tietäen p ja q , on helppo liittää nämä arvot Hardy - Weinberg yhtälö (p² + 2pq + q² = 1).
Kuinka ratkaiset kaksivaiheiset yhtälöt esialgebrassa?

VIDEO Samoin mitkä ovat yhtälön ratkaisemisen 4 vaihetta? 4-vaiheinen opas yhtälöiden ratkaisemiseen (osa 2) Vaihe 1: Yksinkertaista yhtälön jokainen puoli. Kuten viime kerralla opimme, ensimmäinen askel yhtälön ratkaisemisessa on tehdä yhtälöstä mahdollisimman yksinkertainen.
Kuinka ratkaiset murtolukujen kertomisen ja jakamisen?
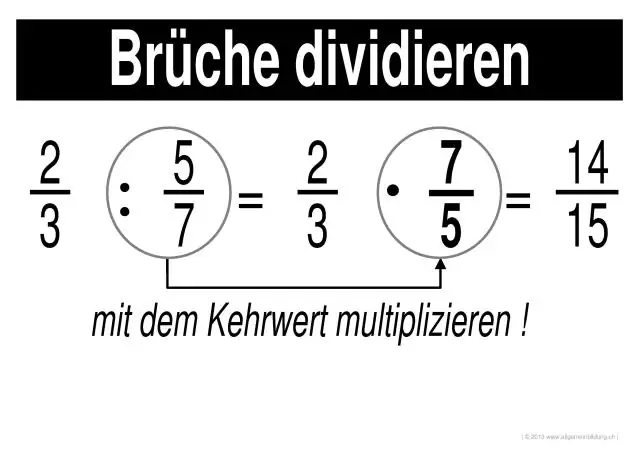
Murtolukujen kertominen ja jakaminen Vaihe 1: Kerro jokaisen murtoluvun osoittajat toisillaan (yläpuolella olevat numerot). Tulos on vastauksen osoittaja. Vaihe 2: Kerro kunkin murtoluvun nimittäjät toisilla (numerot alareunassa). Tulos on vastauksen nimittäjä. Vaihe 3: Yksinkertaista tai vähennä vastausta
Kuinka ratkaiset eksponenttisäännön?
Siirrä vain negatiivisia eksponenteja. Tuotesääntö: am ∙ an = am + n, tämä sanoo, että kun haluat kertoa kaksi eksponenttia samalla kantalla, säilytät kanta ja lisäät potenssit., tämä sanoo, että jakaaksesi kaksi eksponenttia samalla kantalla, säilytät kanta ja vähennä tehot
