
- Kirjoittaja Miles Stephen [email protected].
- Public 2023-12-15 23:36.
- Viimeksi muokattu 2025-01-22 16:58.
Ideaalikaasulaki, kuten sanonta kuuluu, on itse asiassa PV = nRT , kaikilla vakiomuuttujilla. Tässä n=m/M, missä m on kaasun massa ja M on kaasun molekyylipaino. Lyhyesti sanottuna R in PV = nRT pienennetään afaktorilla M (molekyylipaino), jotta R saadaan sisään PV = mRT.
Yksinkertaisesti niin, mikä r on yhtä kuin pV nRT:ssä?
Ihanteellinen kaasulaki on: pV = nRT , jossa n on moolien lukumäärä ja R on yleinen kaasuvakio. Arvo R riippuu mukana olevista yksiköistä, mutta se ilmoitetaan yleensä S. I.-yksiköillä seuraavasti: R = 8,314 J/mol. Tämä tarkoittaa, että voit käyttää arvoa ilmalle R = 287 J/kg.
Samoin mitä R tarkoittaa kemiassa pV nRT? Yleisen kaasuvakion yksiköt R on johdettu yhtälöstä PV=n R T. Se seisoo varten Regnault.
Tässä suhteessa mitä N tarkoittaa pV nRT:ssä?
. Fysikaalinen laki, joka kuvaa ihanteellisen kaasun mitattavissa olevien ominaisuuksien suhdetta, jossa P (paine) × V (tilavuus) = (moolien määrä) × R (kaasuvakio) × T (lämpötila kelvineinä). Se on johdettu Boylen, Charlesin ja Avogadron kaasulakien yhdistelmästä. Kutsutaan myös yleiseksi kaasulakiksi.
Mikä on M ideaalikaasulaissa?
Alkuperäinen ihanteellinen kaasulaki käyttää kaavaa PV =nRT, tiheysversiota ihanteellinen kaasulaki on PM = dRT, jossa P on ilmakehissä mitattu paine (atm), T on lämpötila mitattuna kelvineissä (K), R on ihanteellinen kaasulaki vakio0,0821 at m (L) m ol(K) aivan kuten alkuperäisessä kaavassa, mutta M on nyt moolimassa (g m ol
Suositeltava:
Mitä eroa on korrelaation ja chi-neliön välillä?
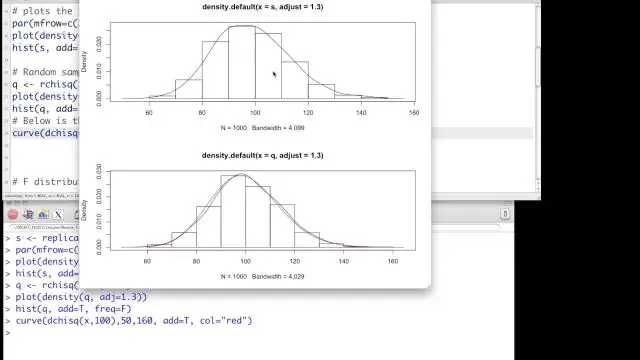
Joten korrelaatiossa on kyse kahden muuttujan välisestä lineaarisesta suhteesta. Yleensä molemmat ovat jatkuvia (tai melkein niin), mutta tapauksiin, joissa toinen on kaksijakoinen, on vaihteluita. Chi-neliö tarkoittaa yleensä kahden muuttujan riippumattomuutta. Yleensä molemmat ovat kategorisia
Mitä eroa on ilmastovyöhykkeen ja biomin välillä?

Ilmasto luokitellaan ilmakehän lämpötilan ja sateen perusteella, kun taas biomi luokitellaan ensisijaisesti yhtenäisten kasvillisuustyyppien perusteella. Ilmasto voi määrittää, mitä biomi on läsnä, mutta biomi ei yleensä hallitse tai vaikuta ilmastoon samalla tavalla
Mitä eroa on yleisen kemian ja orgaanisen kemian välillä?
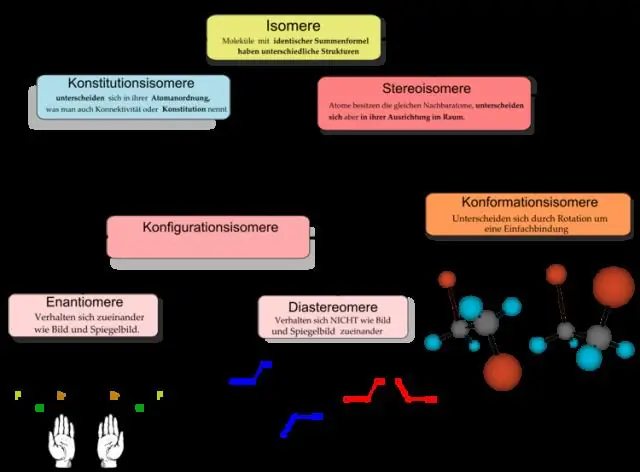
Orgaanista kemiaa pidetään kemian alatieteenä. Kun yleinen kattotermi "kemia" koskee kaiken aineen koostumusta ja muunnoksia yleensä, orgaaninen kemia rajoittuu vain orgaanisten yhdisteiden tutkimukseen
Mitä eroa on 120 ja 277 voltin välillä?

240 volttia mitataan linjasta linjaan ja 120 volttia mitataan joko linjasta nolla- tai maadoitettuun johtimeen. 480 volttia käytetään yleensä moottoreille ja joillekin laitteille, ja 277 volttia käytetään valaistukseen. Näissä järjestelmissä tarvitaan muuntaja 120 voltin pistorasian saamiseksi
Mitä eroa on syvyyden ja leveyden välillä?

Pituus on kuinka pitkä jokin on, leveys on kuinka leveä jokin on, leveys on kuinka korkea jokin on, korkeus on kuinka korkea jokin on, ja syvyys on kuinka syvä jokin on. Vaikka niitä kaikkia voidaan joskus käyttää vaihtokelpoisina, niitä käytetään yleensä kuten ensimmäisessä kappaleesimerkki
