- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimeksi muokattu 2025-01-22 16:58.
Joten, me laskea se ottamalla painotettu massa - jokaisesta isotoopista ja lisäämällä ne yhteen. Eli ensimmäiseksi massa -, kerromme 0,50 % luvusta 84 (mu - atomimassa yksikköä) = 0,042 amu, ja lisää se 9,9 prosenttiin 86 amu = 8,51 amu ja niin edelleen.
Tämän jälkeen voidaan myös kysyä, kuinka lasket keskimääräisen atomimassan?
Keskimääräisen atomimassan laskeminen The keskimääräinen atomimassa elementin summa on summa massat sen isotoopeista, jokainen kerrottuna sen luonnollisella runsaudella (desimaali, joka liittyy prosenttiin atomeja kyseisestä alkuaineesta, jotka ovat tiettyä isotooppia). Keskimääräinen atomimassa = f1M1 + f2M2 +…
Tiedä myös, mitä kolmen tyyppisiä tietoja tarvitaan keskimääräisen atomimassan laskemiseen? Elementille olemassa olevien isotooppien määrä. The Atomi Numero elementille. Jokaisen isotoopin prosenttiosuus.
Voidaan myös kysyä, mikä arvo on lähimpänä strontiumin atomimassaa?
Strontium . Vuoden 1961 raportissaan komissio suositteli Ar(Sr) = 87,62 perustuen massa --Nierin spektrometrinen määritys. Tämä arvo muutettiin A:ksir(Sr) = 87,62(1) vuonna 1969 ja se on pysynyt muuttumattomana siitä lähtien.
Mikä on massa 1 amu?
Atomimassayksikkö (symboloitu AMU tai amu) määritellään täsmälleen 1/12 hiiliatomin massasta 12. Hiili-12 (C-12) -atomissa on kuusi protonit ja kuusi neutroneja sen ytimessä. Epätarkalla ilmaisulla yksi AMU on keskiarvo protoni lepomassa ja neutroni lepomassa.
Suositeltava:
Mikä on strontiumin liekin väri?

Liekkitestit Elementin väri Rubidiuminpunainen (punavioletti) Cesiumsininen/violetti (katso alla) Kalsiumoranssinpunainen Strontiuminpunainen
Miten löydät keskimääräisen osuuden?
Tapa löytää suhteellinen keskiarvo on kertoa nämä kaksi lukua yhteen ja löytää sitten niiden neliöjuuri. Se on suhteellinen keskiarvo
Miten löydät keskimääräisen vapaan polun?

Keskimääräinen vapaa polku on matka, jonka molekyyli kulkee törmäysten välillä. Keskimääräinen vapaa reitti määräytyy kriteerin mukaan, että "törmäysputkessa" on yksi molekyyli, jonka molekyylin liikerata pyyhkäisee pois. Kriteeri on: λ (N/V) π r2 ≈ 1, jossa r on molekyylin säde
Kuinka lasket boorin atomimassan?
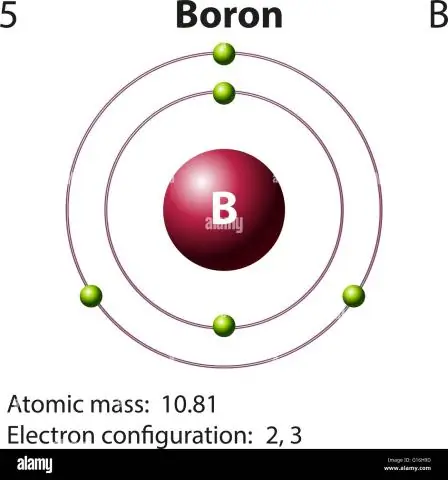
Boorille tämä yhtälö näyttää tältä: 5 protonia + 5 neutronia = 10 atomimassayksikköä (AMU) tai yleisemmin esiintyvälle boori-isotoopille (noin 5 protonia + 6 neutronia = 11 AMU)
Kuinka lasket atomimassan harjoitusongelmat?
VIDEO Miten sitten ratkaistaan atomimassaongelmat? Vastaanottaja laskea the atomimassa alkuaineen yksittäisestä atomista, laske yhteen massa - protoneista ja neutroneista. Esimerkki: Etsi atomimassa Hiilen isotooppi, jossa on 7 neutronia.
