
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimeksi muokattu 2025-01-22 16:58.
Ylimääräisen kiertoradan vuoksi atomisäteet kasvavat ja elektronit ovat kauempana ytimestä. Siten se vie vähemmän energiaa erottamaan elektronin ytimestä. Ylimääräisen kiertoradan elektronitiheys on kauempana ytimestä, ja tästä syystä pieni pudotus ionisaatioenergiaa.
Kun tämä otetaan huomioon, miksi ionisaatioenergiassa on eroja?
The ristiriitaisuuksia voidaan selittää joko elektronien suojauksella tai elektronien hylkimisellä. Trendille atomisäde on vähentyä ajan mittaan ja kasvattaa perhettä. Kun siirrymme jakson poikki, ydinvaraus kasvaa vetäen elektroneja sisään voimakkaammin.
Myöhemmin kysymys kuuluu, miksi S:n ionisaatioenergia on pienempi kuin P? 3:sta lähtien s elektroneja sisään rikki (että rikki häviäisi) on paritettu, rikki sillä on enemmän elektronien hylkimistä näillä kiertoradoilla kuin fosfori tekee, joten se vie vähemmän energiaa tulo elektronin poistamiseksi rikki . Siksi siitä lähtien ionisaatio tapahtuu helpommin, ionisaatioenergiaa On pienempi.
Samoin miksi ionisaatioenergia putoaa Mg:stä Al:iin?
The ensimmäinen on välillä Mg ja Al , koska the ulompi elektroni Mg on mukana the orbital 3s, kun taas sen Al on 3p. The 3p elektronissa on enemmän energiaa kuin the 3s elektroni, niin ionisaatioenergiaa / Al on itse asiassa pienempi kuin Mg.
Miten määrität elektronegatiivisuuden?
Laskea elektronegatiivisuus , aloita siirtymällä verkkoon osoitteeseen löytö an elektronegatiivisuus pöytä. Voit sitten arvioida kahden atomin välisen sidoksen laatua etsimällä niitä elektronegatiivisuudet pöydälle ja vähennä pienempi isommasta. Jos ero on pienempi kuin 0,5, sidos on ei-polaarinen kovalenttinen.
Suositeltava:
Kuinka paljon lämpötila laskee 100 metriä kohden?

"Standard Environmental" (ilma itsessään ei liiku ylös tai alas) lämpötilan hidastumisnopeus (lasku) troposfäärissä on ~2 celsiusastetta (3,5 astetta F) 1000 jalan korkeuden nousua kohti. 1000 jalkaa on ~305 metriä. 100 metrin nousu merenpinnasta johtaisi tällöin 2/3 asteiseen lämpötilan laskuun
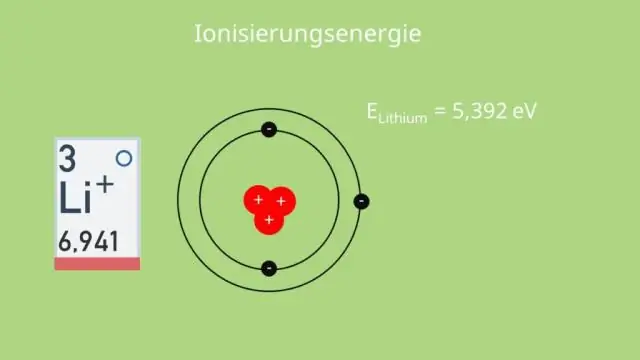
Miksi litiumin toinen ionisaatioenergia on niin epätavallisen suurempi kuin ensimmäinen?

Toinen ionisaatioenergia on aina korkeampi kuin ensimmäinen johtuen kahdesta pääasiallisesta syystä: Poistat elektronin paikasta, jossa se on hieman lähempänä ydintä, ja siksi se vetää voimakkaammin ytimeen
Mikä on elektronegatiivisuuden suuntaus, joka laskee ryhmää?
Joten kun siirryt alas jaksollisessa taulukossa, elementin elektronegatiivisuus pienenee, koska lisääntynyt energiatasojen lukumäärä asettaa ulommat elektronit hyvin kauas ytimen vetovoimasta. Elektronegatiivisuus kasvaa, kun siirryt vasemmalta oikealle jaksollisen järjestelmän poikki
Miksi ionisaatioenergia kasvaa?

Alkuaineiden ionisaatioenergia kasvaa liikkuessa ylöspäin tietyssä ryhmässä, koska elektronit pysyvät alhaisemman energian kiertoradalla, lähempänä ydintä ja siten tiukemmin sidottuina (vaikeammin poistettavissa)
Missä mielessä kuu laskee kohti Maata?

Kuu kiertää maata, mikä tarkoittaa, että se on painovoimansa alainen. Tämä tarkoittaa, että sitä vedetään planeetta kohti jatkuvalla voimalla ja kuuta vedetään sitä kohti. Mutta se liikkuu tarpeeksi nopeasti, jotta Maan painovoima ei ole tarpeeksi vahva vetääkseen sitä kohti pintaa
