Sisällysluettelo:
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:35.
- Viimeksi muokattu 2025-01-22 16:58.
Molekyylikaavat kertoa kuinka monta atomia kussakin elementissä on yhdisteessä, ja empiiriset kaavat kerro yksinkertaisin tai pienennetty alkuaineiden suhde yhdisteessä. Jos yhdiste on molekyylikaava ei voida enää vähentää, niin empiirinen kaava on sama kuin molekyylikaava.
Yksinkertaisesti niin, kuinka löydät molekyylikaavan empiirisesta kaavasta?
Jaa yhdisteen moolimassa empiirinen kaava massa. Tuloksen tulee olla kokonaisluku tai hyvin lähellä kokonaislukua. Kerro kaikki alaindeksit empiirinen kaava vaiheessa 2 löydetyllä kokonaisluvulla. Tulos on molekyylikaava.
mikä on empiirinen kaava yhdisteelle, jonka molekyylikaava on s6o9? jos molekyylikaava on S6O9 saadakseen empiirinen kaava etsimme lukua, joka jakaa 6:een ja 9:stä viiteen pienimmän kokonaislukusuhteen (joka on empiirinen kaava !).
Yksinkertaisesti niin, kuinka löydät molekyylikaavan empiirisesta kaavasta ja moolimassasta?
Empiirinen kaava paino = (1 x 12,01 g/mol) + (2 x 1,01 g/mol) + (1 x 16,00 g/mol) = 30,02 g/mol. Jaa moolimassa varten molekyylikaava mukaan empiirinen kaavamassa . Tulos määrittää, kuinka monta kertaa alaindeksit kerrotaan empiirinen kaava saadakseen molekyylikaava.
Kuinka ratkaiset empiirisen kaavan?
Empiirisen kaavan laskenta
- Vaihe 1: Laske kunkin elementin massa grammoina. Alkuaine % = massa g = m.
- Vaihe 2: Määritä kunkin läsnä olevan atomityypin moolimäärä.
- Vaihe 3: Jaa kunkin elementin moolimäärä pienimmällä moolimäärällä.
- Vaihe 4: Muunna luvut kokonaisluvuiksi.
Suositeltava:
Miksi magnesiumoksidin empiirinen kaava on MgO?

Magnesiumoksidin empiirinen kaava on MgO. Magnesium on +2-kationi ja oksidi on -2-anioni. Koska varaukset ovat yhtä suuret ja vastakkaiset, nämä kaksi ionia sitoutuvat toisiinsa atomisuhteessa 1:1
Mikä on oktaanin empiirinen kaava?

C8H18 Mikä tässä on oktaanin c8h18 empiirinen kaava? The oktaanin empiirinen kaava $$C_{8}H_{18}$$ on: A. B. C. Samoin mikä on c2h6o2:n empiirinen kaava? Molekyyli- ja empiiriset kaavat Kysymys Vastaus Kirjoita empiirinen kaava seuraavalle yhdisteelle:
Mikä on kofeiinin empiirinen kaava?
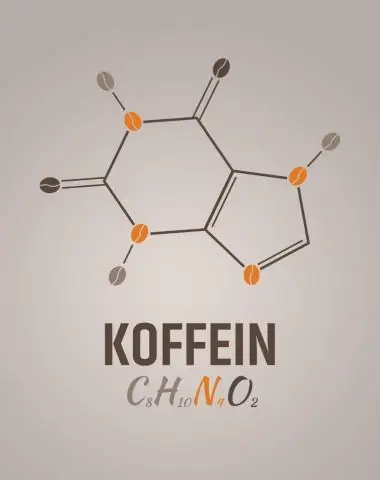
2 vastausta. C8H10N4O2 on kofeiinin molekyylikaava
Mikä on strontiumbromidin empiirinen kaava?

SrBr2 Mikä sitten on strontiumbromidin kaava? SrBr2 Lisäksi onko strontiumbromidi vesipitoista? Noin Strontiumbromidi Heksahydraatti Erittäin puhtaita, erittäin puhtaita, submikronisia ja nanojauhemuotoja voidaan harkita. Suurin osa metallista bromidi yhdisteet ovat vesiliukoisia.
Mikä on yhdisteen empiirinen kaava?

Yhdisteen empiirinen kaava on yhdisteen kunkin atomityypin yksinkertaisin kokonaislukusuhde. Se voi olla sama kuin yhdisteen molekyylikaava, mutta ei aina. Empiirinen kaava voidaan laskea tiedoista yhdisteen kunkin alkuaineen massasta tai prosenttikoostumuksesta
