
- Kirjoittaja Miles Stephen stephen@answers-science.com.
- Public 2023-12-15 23:36.
- Viimeksi muokattu 2025-01-22 16:58.
Kloori isotooppi 18 neutronin runsaus on 0,7577 ja massaluku 35 amu. Laskemaan keskiverto atomimassa, kerro murto-osa kunkin massaluvulla isotooppi ja lisää ne sitten yhteen.
Vastaavasti mikä on alkuaineen kaikkien isotooppien painotettu keskiarvo?
Käyttämällä eri massoja isotoopit ja kuinka runsaasti kukin isotooppi on, voimme löytää keskiverto an atomien massa elementti . An atomimassa elementti on painotettu keskiarvo atomien massa luonnossa esiintyvässä näytteessä elementti . Atomimassa ilmoitetaan tyypillisesti atomimassayksiköissä.
mikä on massa 1 amu? Atomimassayksikkö (symboloitu AMU tai amu) määritellään täsmälleen 1/12 hiiliatomin massasta 12. Hiili-12 (C-12) -atomissa on kuusi protonit ja kuusi neutroneja sen ytimessä. Epätarkalla ilmaisulla yksi AMU on keskiarvo protoni lepomassa ja neutroni lepomassa.
Toiseksi, kuinka lasket runsausprosenttia atomimassan avulla?
Vaihda jokainen prosentin runsaus desimaalimuotoon jakamalla 100:lla. Kerro tämä arvo arvolla atomimassa tuosta isotoopista. Laske yhteen jokaista isotooppia kohden saadaksesi keskiarvon atomimassa.
Mitä eroa on atomimassalla ja atomipainolla?
Atomimassa (ma) on massa - an atomi . Sinkku atomi sillä on tietty määrä protoneja ja neutroneja, joten massa - on yksiselitteinen (ei muutu) ja on protonien ja neutronien lukumäärän summa atomissa . Atomipaino on painotettu keskiarvo massa - kaikista atomeja isotooppien runsauden perusteella.
Suositeltava:
Kuinka löydät puuttuvan luvun, kun annat sen keskiarvon?

Lukujoukon keskiarvo on näiden lukujen keskiarvo. Voit löytää keskiarvon lisäämällä numerojoukon ja jakamalla lukujen määrällä. Jos sinulle annetaan teema ja sinua pyydetään etsimään puuttuva luku näistä joukosta, käytä yksinkertaista yhtälöä
Kuinka löydät keskihajonnan ja keskiarvon Excelissä?
Keskihajonta on mitta siitä, kuinka paljon varianssia lukujoukossa on verrattuna lukujen keskiarvoon (keskiarvoon). Voit laskea keskihajonnan Excelissä käyttämällä yhtä kahdesta ensisijaisesta funktiosta tietojoukosta riippuen. Jos tiedot edustavat koko väestöä, voit käyttää STDEV:tä. Pfunktio
Kuinka luot painotetun keskiarvon pivot-taulukossa?

Painotetut keskiarvot pivot-taulukossa Napsauta Pivot-taulukon-sanan vieressä olevaa alanuolta Pivot-taulukko-työkalupalkin vasemmalla puolella. Valitse kaavat | Lasketut kentät. Kirjoita Nimi-ruutuun uuden kentän nimi. Kirjoita Kaava-ruutuun kaava, jota haluat käyttää painotetussa keskiarvossa, kuten =WeightedValue/Weight. Napsauta OK
Kuinka löydät taulukon keskiarvon ja mediaanin?
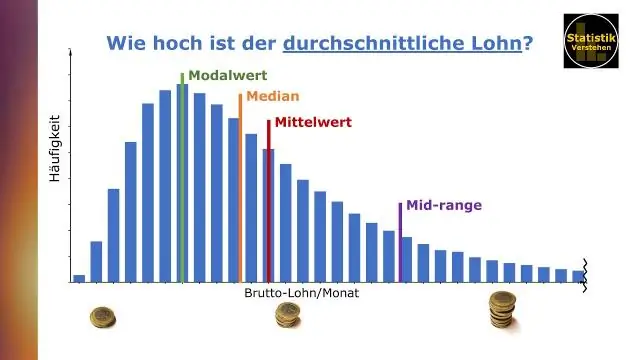
Tietojen välittäminen Tableaun kanssa, Ben Jones Keskiarvo (tai keskiarvo) määritetään summaamalla kaikki tietojoukon arvot ja jakamalla arvojen lukumäärällä. Mediaani on tietojoukon keskiarvo, jossa arvot on asetettu suuruusjärjestykseen
Kuinka löydät keskiarvon Excelillä?
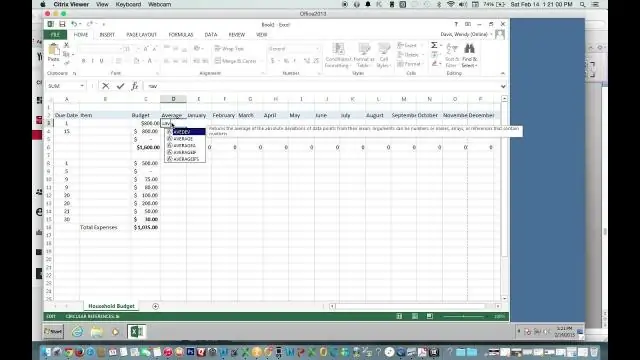
Käytä automaattista summaa löytääksesi nopeasti keskiarvon Napsauta solua sarakkeen alapuolella tai niiden numeroiden rivin oikealla puolella, joille haluat löytää keskiarvon. Napsauta HOME-välilehdellä Automaattinen summa > Keskiarvo vieressä olevaa nuolta ja paina sitten Enter-näppäintä
